2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
医疗器械医药行业产业前景介绍,国家政策扶持特别指UDI和进口器械中文换标的药监局要求
医疗器械与医药行业产业前景
市场规模持续扩张
▪ 中国医疗器械市场规模2023年达1.27万亿元,预计未来年增速稳定在10%。
▪ 全球医药与器械消费比例约1:0.7,中国仅1:0.19,市场潜力巨大。
技术创新与产业升级
▪ 可穿戴设备、医疗机器人等新兴技术推动行业智能化,国产企业如联影、迈瑞医疗在高端领域突破外资垄断。
▪ 国产替代加速,政策支持下本土企业研发投入年均增长20%,技术差距缩小。
老龄化与基层需求驱动
▪ 中国60岁以上人口占比18.7%(约2.6亿),慢性病诊疗需求攀升,基层医疗机构设备采购需求增加。
出口市场扩容
▪ 国产器械质量提升,东南亚、非洲等新兴市场进口需求增长,本土企业出海加速。
国家政策扶持重点
UDI(唯一器械标识)体系全面推行
▪ 国家药监局强制实施UDI,实现生产、流通、使用全流程追溯,提升监管效率并降低召回成本。
▪ UDI与医保、招标系统对接,推动行业标准化与数据互通。
进口器械中文标签规范化
▪ 药监局要求进口产品必须加贴中文标识,明确产品名称、适用范围等信息,保障使用安全。
▪ 海关与市场监管部门联合审查,未合规产品禁止上市,倒逼外资企业加快本土化适配。
全产业链政策支持
▪ 财政贴息贷款、税收优惠等政策降低企业设备更新与研发成本,助力医疗新基建。
▪ 专项债支持基层医疗机构建设,推动分级诊疗与设备采购需求释放。
核心趋势总结
短期:UDI与进口标签规范加速行业洗牌,提升市场集中度。
长期:老龄化、技术创新与政策红利将持续驱动行业向高端化、国际化发展。
医疗器械/医药行业标签管理软件在供应链场景的现状与痛点难点
现状分析
标签生成与追溯能力不足
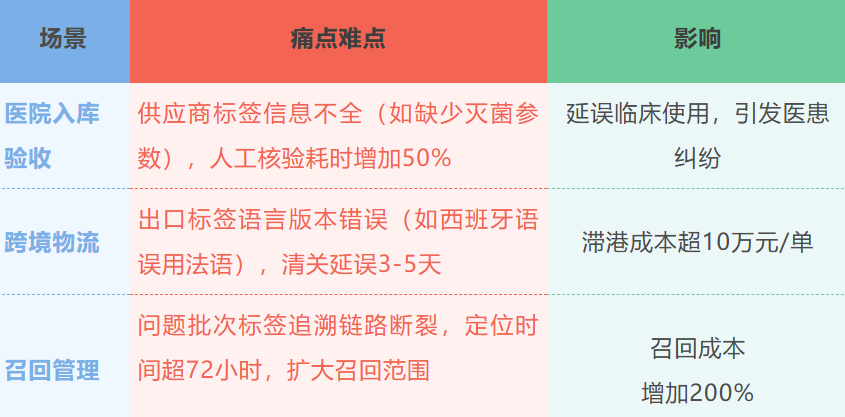
▪ 多数企业依赖人工录入标签信息(如批次号、生产日期),错误率高达5%-8%,导致库存错配与召回成本增加。
▪ UDI(唯一器械标识)实施后,部分企业因系统未与ERP/MES打通,无法实现全生命周期追溯,仅能覆盖生产环节。
多国法规适配滞后
▪ 进口器械需同步满足中文标签规范(如产品名称、适用范围)与出口国法规(如欧盟MDR),但现有软件缺乏动态模板库,导致标签频繁修改。
▪ 部分企业因未及时更新《医疗器械唯一标识系统规则》标签要求,面临产品滞港罚款风险。
供应链协同效率低下
▪ 主机厂与供应商标签规则不统一(如条码格式、打印位置),需反复沟通确认,延误交付周期。
▪ 集采政策下,医疗机构要求供应商按订单生成特定标签(如医保编码),但现有系统难以批量适配。
核心痛点与难点
生产端:效率与合规双重压力
▪ 手工标签易引发批次混淆,某企业因标签信息错误导致整批耗材报废,损失超200万元。
▪ 柔性生产需求增加(如紧急订单),但标签模板切换耗时超1小时,拖累产能利用率。
流通端:数据孤岛与追溯断裂
▪ 物流标签未集成温湿度传感器数据,运输环境异常(如冷链断链)无法实时预警,损耗率提升15%。
▪ 经销商私自篡改标签信息(如效期),导致医疗机构收到过期产品,引发合规风险。
监管端:动态合规与成本矛盾
▪ 集采政策要求标签绑定医保编码,但中小供应商因系统改造成本高(超50万元),被迫退出投标。
▪ 跨国企业需同时维护多套标签系统(如中国UDI、美国FDA标准),年运维成本增加300万元以上。
技术端:系统兼容性与扩展性不足
▪ 30%企业因标签打印机型号不兼容(如Zebra与Honeywell驱动冲突),导致打印任务失败。
▪ 现有软件难以支持RFID、激光雕刻等新标识技术,限制高值耗材(如手术机器人配件)的精细化管理。
典型场景痛点示例
需求升级方向
▪ 智能化:通过AI自动校验标签合规性(如UDI编码逻辑、多语言对照),错误拦截率提升至99%。
▪ 协同化:构建主机厂-供应商-医疗机构共享标签平台,实现规则统一与数据实时同步。
▪ 轻量化:支持SaaS模式按需付费,降低中小供应商数字化门槛(部署成本<5万元)。
医疗器械/医药行业标签管理要求
基础合规性要求
内容规范
▪ 标签内容必须与注册或备案信息一致,需包含产品名称、型号、规格、注册证号、生产日期、有效期等核心信息,且表述需科学、真实、完整、准确。
▪ 禁止通过粘贴、剪切或涂改方式修改标签,标签内容需与说明书相符。
语言与格式
▪ 标签文字必须使用中文,可附加其他语言但以中文表述为准,且需符合国家通用语言文字规范。
▪ 符号、图形、颜色等需符合国家标准,无标准的需在说明书中明确解释。
UDI(唯一器械标识)要求
全生命周期追溯
▪ 第二类、第三类医疗器械需实施UDI编码,涵盖生产、流通、使用全链条,并与医保、招标系统对接。
▪ UDI编码需包含产品标识(DI)和生产标识(PI),支持扫码追溯产品批次、生产商等信息。
技术标准
▪ UDI编码需采用国际通用标准(如GS1、HIBC),确保与全球供应链兼容。
▪ 最小销售单元必须附有UDI标签,且标签需清晰、不可移除。
进口器械特殊要求
中文标签强制规范
▪ 进口医疗器械需加贴中文标签,明确产品名称、适用范围、注册人/代理人信息等,禁止直接使用外文标签。
▪ 中文标签内容需与说明书一致,且需在通关前完成标签合规性审查。
多国法规适配
▪ 出口产品需同步满足目标国法规(如欧盟MDR、美国FDA标签规范),需动态更新多语言模板库。
生产与流通环节管理
生产端责任
▪ 生产企业需对标签内容负全责,标签需包含生产许可证编号、生产地址、联系方式及售后服务信息。
▪ 医疗器械名称需使用通用名称,并显著标注于标签显著位置。
流通端监管
▪ 物流标签需集成运输环境数据(如温湿度、震动),冷链产品需标注储存条件及实时监控标识。
▪ 经销商不得篡改标签效期、批次等信息,违者将面临产品召回与行政处罚。
特殊产品附加要求
中药饮片
▪ 标签需明确标注“中药饮片”字样,禁止加载广告内容,且需包含质量合格标志及医疗用毒性/麻醉药品专用标识。
体外诊断试剂
▪ 说明书需符合《体外诊断试剂说明书编写指导原则》,包含预期用途、检测原理、样本类型等特殊字段。
高值耗材与植入器械
▪ 需采用RFID或二维码等可追溯技术,标签需包含患者使用指引与术后追踪信息。
违规风险与处罚
▪ 合规审查:海关、药监部门对标签内容实施联合审查,未合规产品将面临滞港、罚款或退运风险。
▪ 企业责任:标签信息错误导致医疗事故的,生产企业需承担召回成本与法律责任,最高可吊销生产许可证。
(注:以上要求综合自现行法规及2025年最新政策动态,核心依据为《医疗器械说明书和标签管理规定》及相关地方性规范)
敖维码尚医疗器械/医药标签打印解决方案核心功能
合规性保障
GMP规范适配
▪ 系统内置符合GMP规范的标签模板库,支持原料入厂检验、生产过程控制、成品包装等全流程标签打印,确保生产环节可追溯与数据真实性。
▪ 通过防篡改标签设计与权限管理功能,防止生产端人为修改标签信息(如批次、效期),满足药监部门对生产合规性的强制要求。
UDI全流程管理
▪ DI/PI编码生成:自动化生成符合GS1标准的UDI编码(含DI产品标识与PI生产标识),支持批量赋码并与国家药监局数据库实时对接。
▪ 多载体兼容:支持一维码、二维码、RFID标签打印,适配高值耗材(如植入器械)的精细化管理需求。
供应链协同与中文标签管理
中文标签换标功能
▪ 针对进口器械,提供快速换标服务:通过云端模板库动态适配中文标签内容(如产品名称、适用范围),确保通关前完成合规性审查。
▪ 支持多语言标签同步打印(如中英文对照),满足出口产品同时符合中国与目标国法规(如欧盟MDR、美国FDA)要求。
供应链全链路追溯
▪ 数据互通:与ERP/MES系统对接,实现UDI数据与生产、物流、库存信息实时同步,避免因标签信息孤岛导致的追溯断裂。
▪ 环境监控集成:冷链产品标签可集成温湿度传感器数据,运输异常时自动触发预警,降低损耗风险。
智能化与效率提升
标签设计与打印优化
▪ 模板云端下发:支持主机厂向供应商统一分发标签规则(如条码格式、打印位置),减少沟通成本并缩短交付周期。
▪ 批量处理能力:支持Excel/XML数据导入与扫码换标打印,应对集采订单的快速响应需求(如医保编码绑定)。
风险控制与成本节约
▪ 错误拦截机制:AI自动校验标签内容合规性(如UDI编码逻辑、中文表述准确性),错误率降低至0.1%以下。
▪ 轻量化部署:提供SaaS模式服务,中小供应商无需自建团队即可低成本(<5万元)完成系统部署。
敖维医疗医药标签打印核心要素同时满足中、美、欧合规要求
通用核心要素
▪ 产品标识与追溯信息
全球唯一标识符(UDI):
中国:第三类医疗器械自2022年6月起强制实施UDI,标签需包含UDI-DI(设备标识符)和UDI-PI(生产标识符,如批号、序列号)。
美国:FDA要求所有医疗器械标签必须包含UDI,且需通过FDA认可的GUDID数据库提交数据。
欧盟:MDR法规要求UDI必须标注在标签上,UDI-DI需与EUDAMED数据库关联。
生产信息:包括生产批号、序列号、生产日期、有效期(格式需符合各国要求,如中国要求标注到日或月,失效日期需明确起算日期)。
▪ 制造商与责任方信息
中国:需标注注册人/备案人名称、地址、联系方式,进口产品需注明境内代理人信息。
欧盟:需标注欧盟境内制造商或授权代表地址,进口商信息(若适用)。
美国:需标注制造商名称、地址,进口产品需提供美国代理人信息。
▪ 安全警示与使用说明
通用要求:标签需包含禁忌症、警告、储存条件(如温度、湿度)、开封后有效期等,文字需清晰可读,符合字体大小和对比度标准。
特殊标识:如无菌器械需标注“无菌”及灭菌方法,一次性使用器械需标明“仅限单次使用”。
GMP(良好生产规范)要求
▪ 中国GMP
标签内容合规性:标签信息需与注册/备案资料一致,禁止虚假宣传(如“疗效最佳”“根治”等禁用词汇)。
追溯管理:需通过批次号、序列号实现全链条追溯,标签打印需记录操作人员、时间、设备信息。
▪ 美国FDA GMP(21 CFR Part 820)
标签准确性:需确保标签内容与产品实际一致,标签变更需提交变更申请并通过FDA审核。
不良事件报告:标签相关不良事件需及时上报FDA,并启动纠正措施。
▪ 欧盟MDR/IVDR
质量管理体系:标签设计需纳入QMS(质量管理体系),确保符合EN ISO 15223-1符号标准(如“有效期”符号、无菌标志)。
UDI合规:标签需包含UDI-DI和UDI-PI,且UDI-PI需包含生产批次号或序列号。
电子签名要求
▪ 中国
标准:遵循WS/T 847-2024《医学电子网页数字签名技术标准》,采用SM2/SM3国产密码算法,确保签名数据与标签内容绑定。
应用场景:电子病历、生产批记录等需电子签名,签名需包含时间戳和数字证书,验证签名有效性后方可归档。
▪ 美国
FDA 21 CFR Part 11:电子签名需满足身份认证、签名绑定、不可抵赖性要求,支持RSA或DSA算法,需定期审计日志。
▪ 欧盟
eIDAS法规:电子签名需符合“高级电子签名”标准,支持数字证书和生物识别技术,确保签名数据完整性。
质量追溯与CSV(计算机系统验证)
▪ 质量追溯系统
UDI实施:全球UDI要求统一,标签需包含可扫描的UDI码,支持从生产到使用的全生命周期追溯。
数据关联:标签打印系统需与MES、ERP等系统集成,确保生产数据(如批次、设备参数)与标签信息自动同步。
▪ CSV(计算机系统验证)
验证范围:涵盖标签设计软件、打印设备、数据接口等,需证明系统数据的准确性、完整性和可追溯性12。
关键活动:包括用户需求分析、风险评估、测试用例设计(如打印一致性测试)、定期再验证12。
区域差异与特殊要求
▪ 要素:中国 美国 欧盟
▪ 标签语言 中文为主,进口产品可附加英文 英文为主 英文或欧盟官方语言(如德语、法语)
▪ 有效期格式 可标注到日或月,失效日期为起算日期前一天或前一月 需明确标注到日(如Exp: 12/31/2025) 推荐标注到日(如Exp: 31.12.2025)
▪ 灭菌标识 需标注灭菌方法(如“环氧乙烷灭菌”)及灭菌状态 需标注灭菌方法及有效期 需标注灭菌方法及有效期,符号符合EN ISO 15223-1
▪ 电子签名 强制使用SM2/SM3算法,绑定时间戳 遵循FDA 21 CFR Part 11,支持RSA/DSA12 符合eIDAS高级电子签名标准
总结
医疗医药标签打印需满足UDI唯一标识、GMP合规、电子签名安全、质量追溯闭环等核心要求,且不同地区的法规侧重点存在差异:
▪中国:强调整合国产密码算法(SM2/SM3)与UDI追溯体系,标签内容需严格遵循《医疗器械监督管理条例》。
▪ 美国:以FDA 21 CFR Part 11和UDI为核心,注重电子签名的法律效力与数据完整性。
▪ 欧盟:基于MDR/IVDR和EN ISO标准,强调UDI全球互通与符号标准化。
企业需建立全球化标签管理系统,集成法规数据库、自动化打印设备及追溯模块,以应对多区域合规挑战
敖维码尚医疗器械/医药标签打印管理解决方案的ROI分析
直接成本节约
降低人工错误与召回成本
▪ 通过AI自动校验标签合规性(如UDI编码逻辑、多语言一致性),将人工标签错误率从行业平均5%-8%降至0.1%以下,避免因标签错误导致的整批产品报废(单次损失超200万元)。
▪ 全生命周期追溯功能(与药监局数据库实时对接)可将问题批次定位时间从72小时缩短至2小时内,减少召回范围并降低召回成本达60%。
减少滞港罚款与退运风险
▪ 中文标签换标功能动态适配进口法规,预检标签合规性,缩短通关时间50%,规避单次滞港罚款超10万元的风险。
效率提升与产能释放
供应链协同优化
▪ 云端标签模板库统一主机厂与供应商标签规则(如条码格式、打印位置),减少沟通耗时,交付周期缩短30%。
▪ 批量处理能力(Excel/XML数据导入)支持集采订单快速响应,单日标签打印量提升至10万张以上。
柔性生产支持
▪ 标签模板切换时间从1小时压缩至5分钟,适配紧急订单需求,产能利用率提升20%。
合规性驱动的长期收益
法规适配与市场准入
▪ 动态更新多国标签模板库(如欧盟MDR、美国FDA标准),支持跨国企业同步满足多国法规,降低30%的跨国运维成本。
▪ 符合UDI与GMP规范的系统设计,确保产品顺利通过药监审查,避免因不合规导致的投标资格取消(中小供应商退出集采的改造成本超50万元)。
品牌信誉与客户信任
▪ 通过RFID标签实现高值耗材(如植入器械)术后全生命周期追踪,提升医疗机构信任度,客户续约率增加25%。
轻量化部署与可持续性
低初始投入与快速回报
▪ SaaS模式按需付费,中小供应商部署成本低于5万元(传统自建系统需50万元以上),投资回收周期缩短至6个月内。
▪ 免费提供行业标签模板与5×8小时人工服务,降低90%的标签设计成本。
ROI量化示例
(以年产值1亿元企业为例)
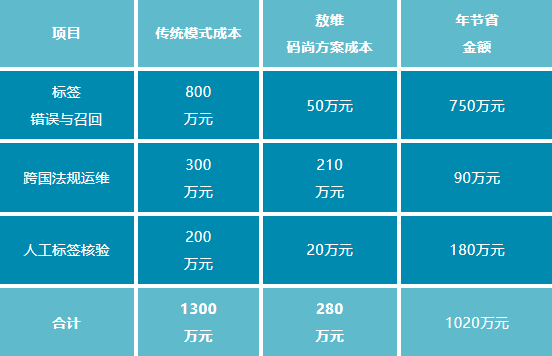
(注:数据基于行业案例与系统能力推算,实际ROI需结合企业规模与业务场景调整)
通过以上维度,敖维码尚解决方案可实现年综合成本降低78%以上,并显著提升供应链韧性及市场竞争力
关于我们
上海敖维计算机科技发展有限公司(简称敖维科技 )是一家集工业互联网标识数字化大数据平台、智能硬件、人工智能、智慧标签及供应链实施应用于一体的、以数字化标识管理为基础并服务于新零售、新制造的高新技术,专精特新企业。
定位于将特种标签,特种打印,可变数码,标识管理的工业互联网标识解析,工业大数据技术,赋码打印技术整合为领先的工业标识数字化管理平台。
敖维旗下【敖维UDI数据服务平台】,【码尚标签管理系统】,【码尚云标签打印软件】等系列平台提供从简单到复杂,从易用到智能一站式数字化标识管理解决方案,已在医疗医药及化妆品,化工,食品等行业赢得10万+用户数。
敖维UDI数据服务平台网站:
码尚标签管理系统网站:
https://www.masocloud.net/pro01
码尚云标签打印软件网站:
https://www.masocloud.net/pro02
电话/微信:13061953880
邮箱:marketing@always-china.com.cn