2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
UDI监管再升级!《医疗器械唯一标识形式和内容》标准7月20日实施,企业合规迎“大考”
国内UDI全新行业标准YY/T1942-2024《医疗器械唯一标识的形式和内容》即将于2025年7月20日起正式实施。
本期带来:中国食品药品检定研究院网站发布的“行业标准解读:YY/T 1942—2024《医疗器械唯一标识的形式和内容》”、标准主要内容摘录↘

一、标准编号、标准名称
YY/T 1942—2024《医疗器械唯一标识的形式和内容》。
二、标准制定背景
我国医疗器械唯一标识(UDI)制度采取多家发码机构并行的方式,在和国际接轨的情况下减少企业的实施成本,实际的操作中识读设备系统兼容难的问题普遍存在,一些流通和使用单位仍存在系统不能识别制造商的条码、无法形成条码化管理系统的现象,极大地影响了各方实施UDI制度的积极性,导致部分流通企业和使用单位依然通过自编码的形式开展医疗器械的管理,额外增加了实施成本、增加了错误识别的可能性。本标准通过规范UDI的形式和内容以及在多码并行情况下UDI的识读和解析,能够解决当前企业混淆UDI和标签内容,尝试将UDI和标签内容融合导致不符合发码机构标准要求导致的条码无法识读的现象,从而提升医疗器械全环节对UDI识读和解析的规范程度,打通整个供应链,提升各方实施UDI的积极性,促进三医联动。
三、标准主要内容
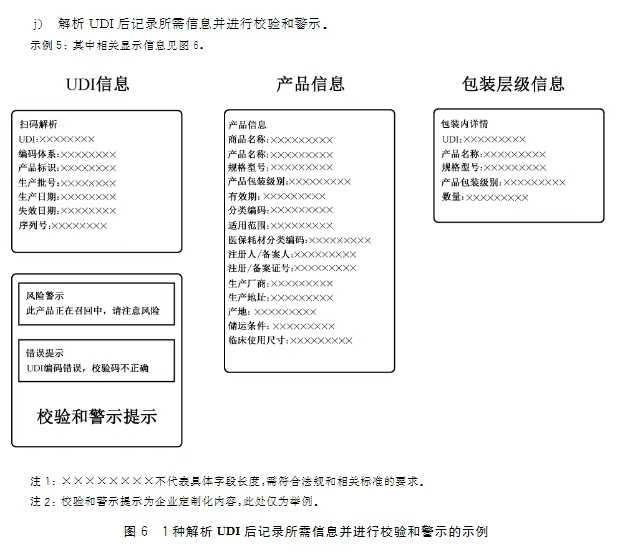
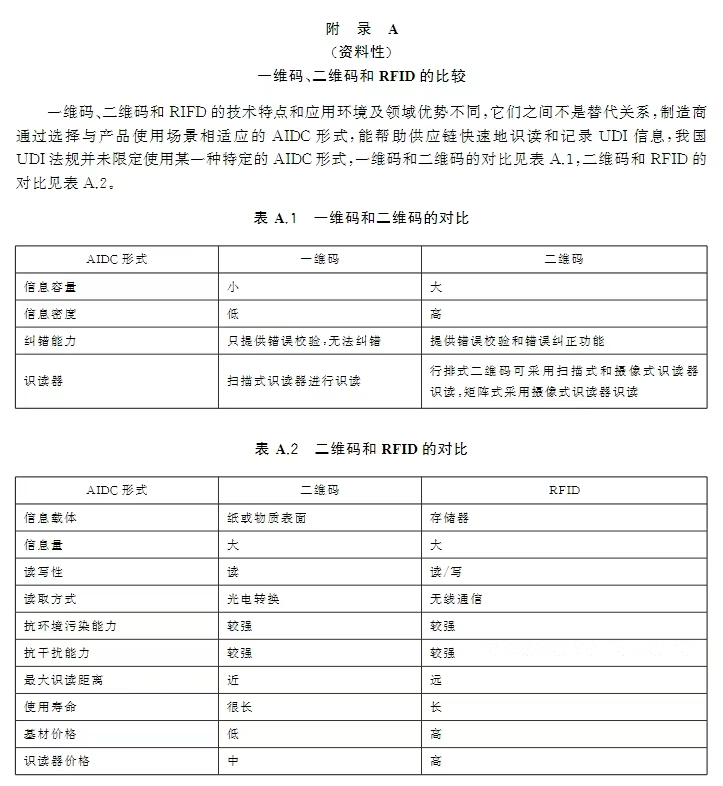
本标准规定了UDI的形式和内容、数据分隔符和UDI的解析。对于UDI的形式部分,明确了本标准中UDI的形式是指以数据载体呈现在医疗器械标签、包装或者医疗器械产品上的方式,数据载体中自动识别和数据采集(AIDC)和人工识读(HRI)部分不应和其他标签信息相互替代,并对AIDC和HRI的具体作用和要求进行了进一步的说明。对于UDI的内容部分,明确了本标准中UDI的内容是指UDI以及其对应人工识读(HRI)和自动识别和数据采集(AIDC)形式中包含的数据信息,并将信息限定为产品标识(UDI-DI)和生产标识(UDI-PI),其中生产批号、序列号、生产日期、失效日期和独立软件的版本号属于UDI-PI。对于数据分隔符部分,本标准明确了发码机构和制造商应通过适当形式提供给相关方基于其编码规则的数据分隔符定义,并给出了示例图表,能够为各相关方正确的解析UDI提供参考,提高供应链扫码识读效率。对于UDI的解析部分,目的在于解决如何使各方快速、准确地读取UDI数据载体,并正确解析出所需要的数据信息,结合我国UDI的实施情况,本标准明确了相关数据信息所包括的内容,并提出了相关要求,给出了适当的场景和案例以供各相关方参考实施。最后,以资料性附录的形式提供了常见AIDC类型的对比,包括一维码和二维码的对比、二维码和射频识别(RFID)的对比,以及IMDRF指南中关于AIDC识读器的考虑因素,以供各相关方参考。
四、标准实施意义
《医疗器械唯一标识系统规则》仅包含规范UDI系统建设的基本要求,在UDI制度实施中需要更多针对各环节操作层面的文件,YY/T 1879—2022《医疗器械唯一标识的创建和赋予》针对UDI的创建和赋予环节提出了要求,但针对各相关方实施和应用UDI过程中遇到的多码并行、UDI载体与标签信息混淆、条码识别和解析等问题尚缺乏明确指导。本标准通过规定UDI的形式和内容,能够有效指导医疗器械注册人/备案人规范UDI的实施,同时有助于医疗器械流通企业和使用单位通过规范的流程识读和解析UDI,从而提升管理水平并进一步打通整个医疗供应链。
五、标准相关问题及解答
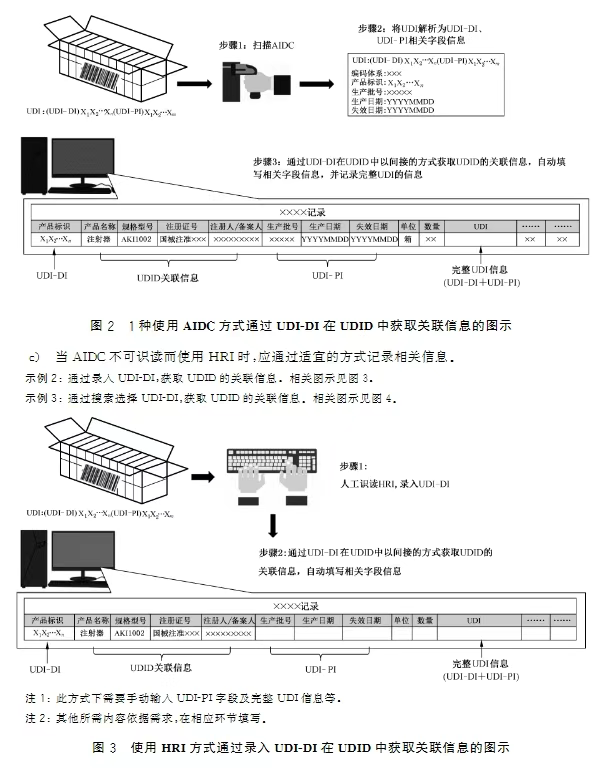
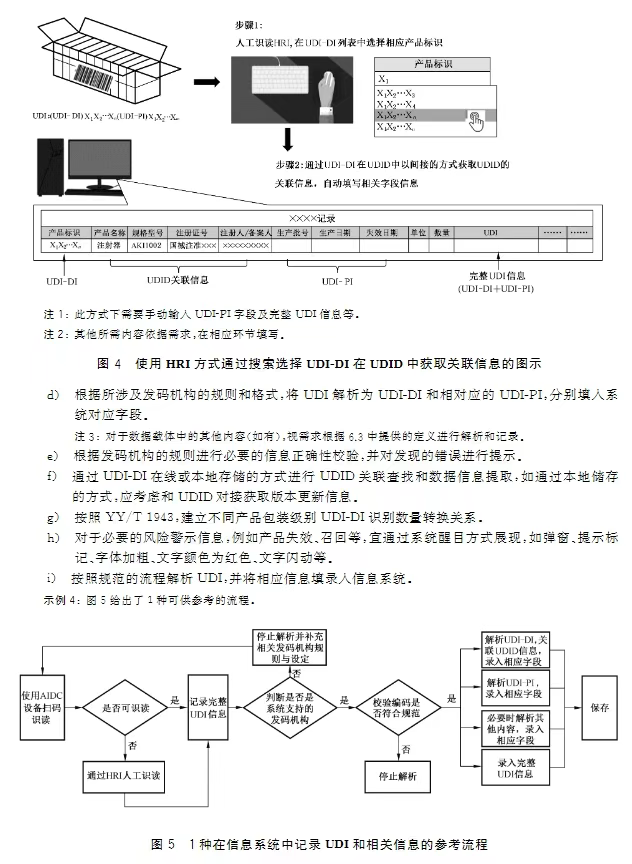
1.UDI数据载体和其他标签信息的关系与区别。答:UDI数据载体AIDC和HRI部分不应和其他标签信息相互替代,可参见标准条款4.1.2相关要求及图1所示。2.作为医疗器械生产企业,如果希望把企业内部的产品控制信息放入数据载体中,应当遵循的原则。答:不建议制造商在UDI数据载体中添加UDI以外的其他内容,如需添加,应符合法律法规和发码机构相关规则和要求,具体参见标准条款5.3、5.4和6.3相关内容和要求。3.针对当前存在的多家UDI发码机构,是否有一个通用的规则去识别和解析UDI。答:发码机构应明确基于其编码规则的UDI数据分隔符定义,并通过适当形式提供给各相关方,医疗器械经营企业和使用单位根据发码机构的规则识别和解析UDI。具体可参见标准第6章数据分隔符及第7章UDI的解析相关内容和要求。4.作为医疗器械的生产企业,如何选择合适的AIDC技术形式和AIDC识读器。答:法规未限制使用特定的AIDC技术形式和识读器,制造商可参见标准条款4.2.3、4.2.5以及附录A和B的相关内容,结合自身产品特点和在供应链中识读需求选择合适的AIDC技术形式和识读器。5.作为医疗器械的经营企业和使用单位,如何通过UDI获取所需医疗器械产品的相关信息。答:医疗器械经营企业和使用单位可参照标准第7章 UDI的解析相关内容和图示指导,考虑自身UDI识读设备、信息化水平和需要获取的信息内容等,通过UDI获取所需产品相关信息







来源:中国食品药品检定研究院
声明:文章为转载,其版权归原作者所有。转载仅用于分享,若涉及文章版权等问题,联系我方删除!
敖维科技UDI服务
UDI数据+医疗器械GMP标识管理系统+进口器械中文换标咨询服务:
提供UDI数据服务、招采前、招采后数据服务。
国内法规咨询-GS1申请注册服务、NMPA数据审核上传咨询服务、UDI合规编码指导等服务;
FDA法规咨询-FDA注册/代理人服务、FDA-510K申报服务、UDI合规编码指导等服务;
CE法规咨询-CE欧代申报服务、CE-PPE个人防护认证服务、UDI合规编码指导等服务。进口器械中文换标业务咨询。满足GMP医疗标识管理系统咨询。
UDI软件+医疗GMP标识管理系统+进口器械中文换标系统合规软件服务:
UDI的数据管理平台、DI数据上传、UDI标识打印、UDI防窜追溯平台及根据不同客户需求的定制化开发,软件自动更新,提供 UDI 作业指导书、程序书及 IQ / OQ / PQ 文件,符合 QMS 与 ISO13485 要求,符合GMP管理要求,进口器械中文标签换标系统。
进口中文换标+GMP医疗标识管理平台,产品管理、客户管理、标签管理、标签打印、包装层级,工序打印,用户权限,标签审核,标识追溯等。
UDI及医疗标识硬件耗材合规服务:
提供在线等级检测标签机、条码检测仪、自动喷码机、彩色标签打印机等UDI硬件设备,为医械产品标识提供切实可行的UDI赋码及等级检测方案。
提供适用一类、二类和三类医械企业的各种医疗设备、IVD(体外诊断)、高值耗材、低值耗材标签材料。
敖维科技承诺5-10个工作日帮助企业完成全套UDI申报,如您有相关UDI合规需求,欢迎咨询15901907957
关于我们
上海敖维计算机科技发展有限公司(简称敖维科技 )是一家集工业互联网标识数字化大数据平台、智能硬件、人工智能、智慧标签及供应链实施应用于一体的、以数字化标识管理为基础并服务于新零售、新制造的高新技术,专精特新企业。
定位于将特种标签,特种打印,可变数码,标识管理的工业互联网标识解析,工业大数据技术,赋码打印技术整合为领先的工业标识数字化管理平台。
敖维旗下【敖维UDI数据服务平台】,【码尚标签管理系统】,【码尚云标签打印软件】等系列平台提供从简单到复杂,从易用到智能一站式数字化标识管理解决方案,已在医疗医药及化妆品,化工,食品等行业赢得10万+用户数。
▪ 敖维UDI数据服务平台网站:https://www.udi-fuwu.com
▪ 码尚标签管理系统网站:https://www.masocloud.net/pro02
▪ 码尚云标签打印软件网站:https://www.masocloud.net/pro01
▪ 电话/微信:13061953880 邮箱:marketing@always-china.com.cn